Время чтения: ок. 4 минуты 26 секунд
19 декабря 2022 г., 11:27
Институт науки и технологий Нара объявил 14 декабря, что разъяснил механизм клеточно-опосредованного иммунитета, который формируется в легочной ткани после заражения вирусом гриппа или введения вакцины и атакует патогены. Это исследование было проведено доцентом Такуми Кавасаки и профессором Таро Каваи из Лаборатории молекулярной регуляции иммунитета Высшей школы передовых наук и технологий, Высшей школы науки и технологий, доцентом Аяко Исогай из Лаборатории инженерии развития органов и Тосихиро. Ито из Медицинского университета Нара, профессор Масахиро Китабата, профессор Кен Исии из Института медицинских наук Токийского университета, профессор Эцуфуми Курода из Медицинского колледжа Хёго и Фумики Такамура, руководитель группы RIKEN. Результаты исследования опубликованы в «Cell Reports».
картинка из релиза
(Для получения дополнительной информации, пожалуйста, проверьте соответствующую ссылку)
Вирус гриппа и новая коронавирусная инфекция обычно приводят к более быстрому и сильному иммунному ответу после второго заражения, чем после первого. Это связано с действием клеток памяти, созданных первой инфекцией, и вакцины, использующие это, способствуют защите от инфекции и подавлению обострения. Приобретение антител против вирусов важно для защиты от инфекции, но в организме человека также есть иммунная система, называемая клеточно-опосредованным иммунитетом, за счет Т-клеток-киллеров в дополнение к антителам. Т-клетки-киллеры реагируют на инфицированные вирусом клетки и уничтожают инфицированные клетки, вызывая гибель клеток. Кроме того, некоторые Т-клетки-киллеры остаются в организме в течение длительного времени в качестве клеток памяти (Т-клетки-киллеры памяти) для подготовки к следующей инфекции. Недавние исследования показали, что Т-клетки-киллеры памяти не циркулируют по всему телу, а остаются в определенных тканях, способствуя местной защите от инфекций и долговременной памяти. Этот тип Т-клеток-убийц памяти называется резидентными Т-клетками-убийцами памяти. В частности, легкие являются основной тканью для инфекций, вызванных новым коронавирусом и гриппом, а Т-клетки-киллеры и резидентные Т-клетки-киллеры памяти в значительной степени способствуют подавлению тяжести заболевания. По этим причинам требуется разработка вакцины, которая может в достаточной степени обеспечивать клеточный иммунитет и долговременную иммунологическую память.
Как альвеолярные макрофаги способствуют пролиферации Т-клеток-киллеров посредством захвата и презентации антигена?
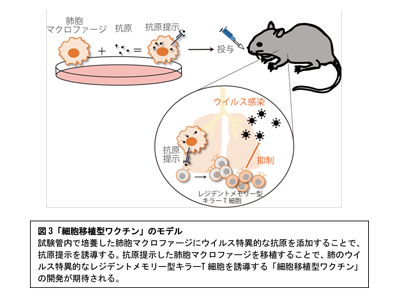
На этот раз исследовательская группа провела анализ с целью выяснения механизма формирования клеточного иммунитета в легком. Чтобы индуцировать клетки памяти, подобные тем, которые вырабатываются при первой инфекции, исследовательская группа сначала вводила мышам подкожно овальбумин (OVA: белок яичного белка), который часто используется в качестве модельного антигена, в качестве вакцины. Подкожная инъекция OVA индуцирует у мышей специфичные для OVA Т-клетки-киллеры. Затем, через 10 дней после инокуляции OVA, OVA вводили интраназально в легкие, а через 5 дней исследовали OVA-специфические Т-клетки-киллеры в легких, и было обнаружено их значительное увеличение. Различные иммунные клетки всегда ждут в легких, чтобы уничтожить болезнетворные микроорганизмы, которые проникают с дыханием. Чтобы исследовать, какие иммунные клетки предшествовали, мы вводили флуоресцентно-меченый OVA в легкие и искали клетки-предшественники, используя флуоресценцию OVA в качестве показателя. В результате было обнаружено, что альвеолярные макрофаги, присутствующие в легких, охотятся на OVA.
Поэтому с использованием генетически модифицированных мышей, не имеющих альвеолярных макрофагов (Csf2-дефицитных мышей), вводили OVA подкожно и вводили интраназально в легкие через 10 дней после прививки OVA, при этом стало ясно, что количество Т-киллеров не увеличилось. Кроме того, когда культивируемые альвеолярные макрофаги нагружали антигенами и трансплантировали мышам без альвеолярных макрофагов, в легких увеличивалось количество антигенспецифических Т-клеток-киллеров. Из этих результатов мы обнаружили, что альвеолярные макрофаги поглощают антигены и способствуют пролиферации Т-клеток-киллеров посредством презентации антигена.
ИЛ-18, секретируемый альвеолярными макрофагами, индуцирует резидентные Т-клетки-киллеры памяти.
Среди Т-клеток-киллеров в легком известно наличие резидентных Т-клеток-киллеров памяти типа, которые остаются в легких в течение длительного периода времени и готовятся к заражению от следующего возбудителя. Также было обнаружено, что некоторые Т-клетки-киллеры, индуцированные альвеолярными макрофагами, остаются в легких в виде резидентных Т-клеток-киллеров памяти. Затем, чтобы исследовать, какие факторы в альвеолярных макрофагах важны для индукции резидентных Т-киллеров типа памяти, мы провели поиск цитокинов (физиологически активных веществ), секретируемых альвеолярными макрофагами, и обнаружили высокую экспрессию интерлейкина 18. Стало ясно. . Следовательно, когда мы исследовали мышей с дефицитом рецептора интерлейкина-18, индукция резидентных Т-клеток-киллеров памяти была подавлена. Другими словами, было обнаружено, что некоторые Т-клетки-киллеры, увеличенные в легких альвеолярными макрофагами, стали резидентными Т-клетками-киллерами памяти благодаря действию интерлейкина-18.
У мышей с дефицитом альвеолярных макрофагов не увеличивается количество легочных Т-клеток-киллеров даже после повторного заражения вирусом гриппа.
Наконец, чтобы прояснить роль альвеолярных макрофагов в реальной вирусной инфекции, мышей дикого типа и Csf2-дефицитных мышей заражали низкими дозами вируса гриппа. Через 30 дней после заражения их повторно заразили смертельной дозой вируса гриппа. В норме при заражении малой дозой вируса гриппа уже формируются клетки памяти, поэтому даже при заражении летальной дозой вируса гриппа позднее они не погибнут. Фактически, когда мы измерили Т-клетки-киллеры в легких и вирусную нагрузку через 5 дней после повторного заражения вирусом гриппа, мы обнаружили, что у мышей дикого типа увеличилось количество Т-клеток-киллеров, специфичных для гриппа, а вирусная нагрузка в легких была подавлена. С другой стороны, у мышей с дефицитом Csf2 не было увеличено количество Т-клеток-киллеров, а вирусная нагрузка в легких была увеличена. Отсюда было обнаружено, что действие альвеолярных макрофагов увеличивало количество вирусспецифических Т-киллеров, которые элиминировали инфицированные клетки и подавляли рост вирусов.
Обеспечение клеточного иммунитета Т-клетками-киллерами, что привело к разработке вакцин, формирующих иммунную память.
Вирусспецифические Т-клетки-киллеры получают в устойчивом состоянии после вакцинации или после инфицирования вирусом. Во время повторного заражения вирусные антигены представляются Т-киллерам альвеолярными макрофагами, что приводит к быстрой пролиферации Т-киллеров и элиминации инфицированных клеток в легких. Кроме того, было обнаружено, что некоторые вирус-специфические Т-клетки-киллеры, размножающиеся альвеолярными макрофагами, сохранялись интерлейкином-18 в качестве резидентных Т-клеток-киллеров памяти.
Легкие являются основной тканью для инфекций, вызванных новым коронавирусом и вирусом гриппа, а Т-клетки-киллеры и резидентные Т-клетки-киллеры памяти в значительной степени способствуют подавлению тяжести заболевания. Поэтому разработка вакцин, обеспечивающих клеточно-опосредованный иммунитет за счет Т-киллеров и формирующих иммунную память, является одной из актуальных проблем.
«На этот раз мы обнаружили, что количество антигенспецифических Т-клеток-киллеров и резидентных Т-клеток-киллеров памяти увеличилось, когда альвеолярные макрофаги, культивированные с антигеном in vitro, были перенесены предварительно иммунизированным мышам с дефицитом Csf2. «Ожидается использование переноса клеточных макрофагов», — заявила исследовательская группа.

 EUROPEAN UNION
EUROPEAN UNION 