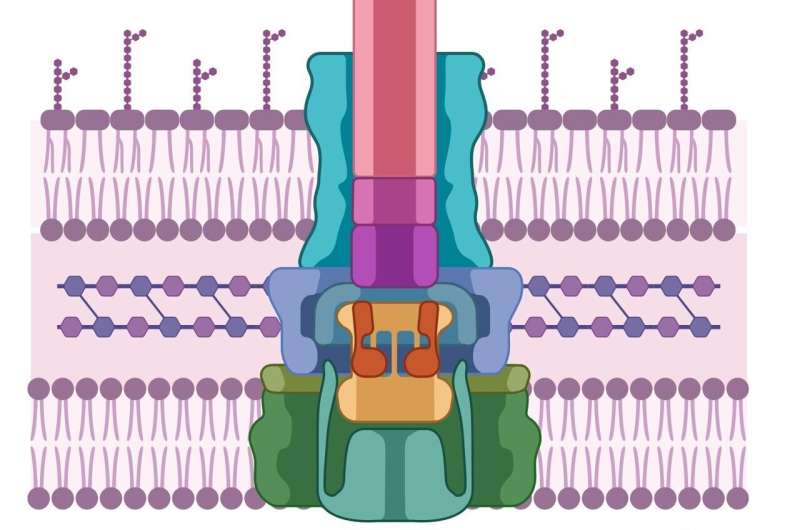
Система секреции типа 3 зависит от двух белков: PopB и PopD (красный и синий), создающих туннель в клеточной стенке хозяина. Фото: Массачусетский университет в Амхерсте.
Устойчивые к антибиотикам «супербактерии», которые могут свести на нет усилия по их уничтожению, представляют собой срочный кризис общественного здравоохранения, и, по данным Центров по контролю заболеваний, ежегодно возникает более 2,8 миллионов устойчивых к антибиотикам инфекций. Исследователи всего мира пытаются решить эту проблему.
Совместная группа исследователей во главе с Массачусетским университетом в Амхерсте, в которую входят ученые из биофармацевтической компании Microbiotix, недавно объявила, что они успешно научились саботировать ключевой механизм, который патогены используют для заражения клеток-хозяев, и разработали тест, способный вывести из строя ключевой механизм, который патогены используют для заражения клеток-хозяев. определить лекарства следующего поколения, способные воздействовать на этот уязвимый клеточный механизм и добиться реальных успехов в общественном здравоохранении.
Типичная стратегия лечения микробных инфекций заключается в уничтожении возбудителя антибиотиком, который проникает внутрь вредоносной клетки и убивает ее. Это не так просто, как кажется, потому что любой новый антибиотик должен быть одновременно водорастворимым, чтобы он мог легко перемещаться по кровотоку, и маслянистым, чтобы преодолеть первую линию защиты патогенной клетки — клеточную мембрану. Вода и масло, конечно, не смешиваются, и сложно создать препарат, который обладал бы достаточным количеством обеих характеристик, чтобы быть эффективным.
На этом трудности не заканчиваются, поскольку патогенные клетки развили нечто, называемое «эффлюксным насосом», который может распознавать антибиотики, а затем безопасно выводить их из клетки, где они не могут причинить никакого вреда. Если антибиотик не может преодолеть откачивающий насос и убить клетку, тогда патоген «запоминает», как выглядит этот конкретный антибиотик, и создает дополнительные откачивающие насосы для эффективной борьбы с ним — по сути, становясь устойчивым к этому конкретному антибиотику.
Один из путей вперед — найти новый антибиотик или их комбинацию и попытаться оставаться на шаг впереди супербактерий.
«Или мы можем изменить нашу стратегию», — говорит Алехандро Хек, доцент кафедры биохимии и молекулярной биологии Массачусетского университета в Амхерсте и старший автор статьи. «Я химик, и мне всегда было очень интересно понять, как химические молекулы взаимодействуют с живыми организмами. В частности, я сосредоточил свои исследования на молекулах, которые делают возможным общение между патогеном и клеткой-хозяином, которую он хочет вторгнуться».
Хойк и его коллеги особенно интересовались системой связи, называемой системой секреции типа 3, которая на данный момент кажется эволюционной адаптацией, уникальной для патогенных микробов.
Как и патогенная клетка, клетки-хозяева также имеют толстые, труднопроницаемые клеточные стенки. Чтобы преодолеть их, патогены разработали машину, похожую на шприц, которая сначала выделяет два белка, известные как PopD и PopB. Ни PopD, ни PopB по отдельности не могут нарушить клеточную стенку, но вместе два белка могут создать «транслокон» — клеточный эквивалент туннеля через клеточную мембрану. Как только туннель установлен, патогенная клетка может инъецировать другие белки, которые выполняют работу по заражению хозяина.
Весь этот процесс называется системой секреции типа 3, и ни один из них не работает без PopB и PopD. «Если мы не попытаемся убить патоген, — говорит Хойк, — у него не будет шансов развить устойчивость. Мы просто саботируем его машину. Патоген все еще жив; он просто неэффективен, и у хозяина есть время». использовать свою естественную защиту, чтобы избавиться от патогена».
Тогда вопрос в том, как найти молекулу, которая сможет заблокировать сборку транслокона?
Иногда решения приходят к ученым в те «моменты лампочки», когда внезапно все обретает смысл. В данном случае это был скорее момент молнии.
Хек и его коллеги поняли, что класс ферментов под названием люциферазы, похожий на те, которые заставляют светлячков светиться ночью, можно использовать в качестве индикатора. Они разделили фермент на две половины. Одна половина вошла в белки PopD/PopB, а другая половина была встроена в клетку-хозяина.
Эти сконструированные белки и хозяева могут быть наполнены различными химическими соединениями. Если клетка-хозяин внезапно загорается, это означает, что PopD/PopB успешно прорвали клеточную стенку, воссоединив две половинки люциферазы, заставив их светиться. А если клетки останутся темными? «Тогда мы узнаем, какие молекулы разрушают транслокон», — говорит Хойк.
Хойк сразу отмечает, что исследования его команды имеют не только очевидное применение в мире фармацевтики и общественного здравоохранения, но и расширяют наше понимание того, как именно микробы заражают здоровые клетки. «Мы хотели изучить, как действуют патогены, — говорит он, — и вдруг обнаружили, что наши открытия могут помочь решить проблему общественного здравоохранения».
Это исследование опубликовано в журнале ОКС Инфекционные болезни.
Больше информации:
Hanling Guo et al., «Клеточный анализ для определения сборки транслоконов системы секреции типа 3 у Pseudomonas aeruginosa с использованием расщепленной люциферазы», ОКС Инфекционные болезни (2023). DOI: 10.1021/acsinfecdis.3c00482.
Предоставлено Массачусетским университетом в Амхерсте.
Цитирование : Исследовательская группа обнаружила, как саботировать устойчивые к антибиотикам «супербактерии» (2023 г., 18 декабря), получено 18 декабря 2023 г. с https://phys.org/news/2023-12-team-sabotage-antibiotic-resistent-superbugs.html.
Этот документ защищен авторским правом. За исключением любых добросовестных сделок в целях частного изучения или исследования, никакая часть не может быть воспроизведена без письменного разрешения. Содержимое предоставлено исключительно в информационных целях.
 EUROPEAN UNION
EUROPEAN UNION 