Задний план
Анапластический рак щитовидной железы является редким и агрессивным раком, для которого не существует стандартного местного лечения на основе лучевой терапии. Основываясь на данных, свидетельствующих о синергизме между пазопанибом и паклитакселом при анапластическом раке щитовидной железы, NRG Oncology провела двойное слепое плацебо-контролируемое рандомизированное клиническое исследование фазы 2, в котором сравнивали одновременную терапию паклитакселом и лучевой терапией с модулированной интенсивностью (IMRT) с добавлением пазопаниба или плацебо с целью улучшения общей выживаемости в этой популяции пациентов.
Методы
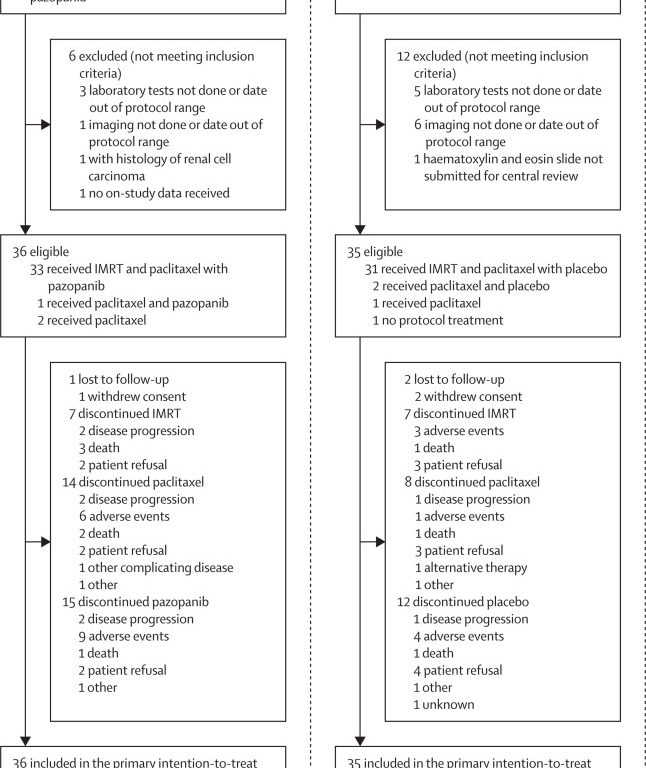
В исследование включались пациенты в возрасте 18 лет и старше с патологическим диагнозом анапластического рака щитовидной железы, любой стадией TNM, общим статусом Zubrod 0–2, отсутствием недавнего кровохарканья или кровотечения и отсутствием метастазов в головной мозг. Пациенты были зарегистрированы из 34 центров в США. Первоначально обкатка была сделана для обеспечения безопасности. В рандомизированном исследовании фазы 2 пациенты экспериментальной группы (пазопаниб) получали паклитаксел еженедельно в течение 2–3 недель (80 мг/м2).2) внутривенно и ежедневно в виде суспензии пазопаниба 400 мг перорально с последующим еженедельным одновременным назначением паклитаксела (50 мг/м2), ежедневный пазопаниб (300 мг) и ЛТМИ 66 Гр в виде 33 ежедневных фракций (фракции по 2 Гр). В контрольной группе (плацебо) пазопаниб был заменен соответствующим плацебо. Пациенты были случайным образом распределены (1:1) на две лечебные группы путем рандомизации переставленных блоков NRG Oncology со стратификацией по метастатическому заболеванию. Все исследователи, пациенты и спонсоры исследования были замаскированы для распределения по группам. Первичной конечной точкой была общая выживаемость в группе пациентов, получавших лечение. Безопасность оценивали у всех пациентов, получивших хотя бы одну дозу исследуемого препарата. Это испытание зарегистрировано на Clinicaltrials.gov, NCT01236547, и оно завершено.
Выводы
Проверка безопасности показала, что окончательный режим дозирования безопасен на основании того, что у двух из девяти участников возникли нежелательные явления, вызывающие предопределенную озабоченность. В период с 23 июня 2014 г. по 30 декабря 2016 г. в исследование фазы 2 было включено 89 пациентов, из которых 71 соответствовал критериям (36 в группе пазопаниба и 35 в группе плацебо; 34). [48%] мужчины и 37 [52%]
самки). При окончательном анализе (отсечение данных 9 марта 2020 г.) при медиане наблюдения 2,9 года (IQR 0,002–4,0) умер 61 пациент. Общая выживаемость не была значительно улучшена при приеме пазопаниба по сравнению с плацебо: медиана общей выживаемости составила 5,7 мес (95% ДИ 4,0–12,8) в группе пазопаниба по сравнению с 7,3 мес (4,3–10,6). ) в группе плацебо (отношение рисков 0,86, 95% ДИ 0,52–1,43; односторонний логарифмический ранг p=0,28). Годовая общая выживаемость составила 37,1% (95% ДИ 21,1–53,2) в группе пазопаниба и 29,0% (13,2–44,8) в группе плацебо. Частота нежелательных явлений 3-5 степени значимо не различалась между группами лечения (пазопаниб 88,9% [32 of 36 patients] и плацебо 85·3%
[29 of 34 patients]; р=0·73). Наиболее частыми клинически значимыми нежелательными явлениями 3–4 степени тяжести у 70 пациентов, соответствующих критериям лечения (36 в группе пазопаниба и 34 в группе плацебо), была дисфагия (13). [36%] против 10 [29%]), лучевой дерматит (8 [22%] против 13 [38%]), повышение аланинаминотрансферазы (12 [33%] против нет), повышенная аспартатаминотрансфераза (восемь [22%] против нет) и оральный мукозит (пять [14%] против восемь [24%]). Серьезные нежелательные явления, связанные с лечением, были зарегистрированы у 16 (44%) пациентов, принимавших пазопаниб, и у 12 (35%) пациентов, принимавших плацебо. Наиболее частыми серьезными побочными эффектами были дегидратация и тромбоэмболия (три [8%] каждый) у пациентов, принимавших пазопаниб, и орального мукозита (три [8%]) у тех, кто принимал плацебо. В каждой группе была зарегистрирована одна связанная с лечением смерть (сепсис в группе пазопаниба и пневмонит в группе плацебо).
Интерпретация
Насколько нам известно, это исследование является крупнейшим рандомизированным исследованием анапластического рака щитовидной железы, в котором было завершено накопление, демонстрирующее осуществимость в многоцентровой национальной сети клинических испытаний NCI. Хотя в группе пазопаниба не было зарегистрировано значительного улучшения общей выживаемости, было показано, что комбинация лечения возможна и безопасна, и были получены данные, формирующие гипотезы, которые могут потребовать дальнейшего изучения.
Финансирование
Национальный институт рака и Novartis.
 EUROPEAN UNION
EUROPEAN UNION 