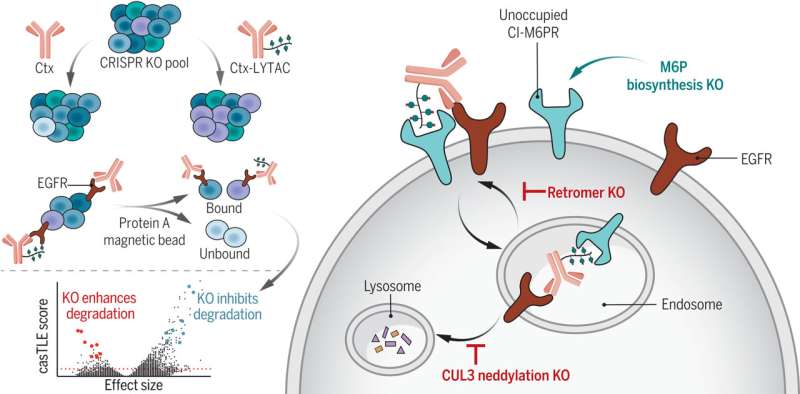
Идентификация клеточных детерминант LYTAC-опосредованной деградации мембранных белков. Был проведен полногеномный CRISPR-скрининг для выявления факторов, регулирующих LYTAC-опосредованную деградацию рецептора эпидермального фактора роста (EGFR) посредством магнитной сортировки клеток. Нокаут (КО) ретромерного комплекса приводил к снижению рециркуляции комплекса LYTAC-мишень. Неддиляция CUL3 необходима для лизосомального транспорта и деградации. Нарушение пути биосинтеза M6P привело к увеличению количества незанятого CI-M6PR на поверхности клеток, что усилило интернализацию LYTAC-рецептора. Ctx, цетуксимаб. Кредит: Наука (2023). DOI: 10.1126/science.adf6249.
При воздействии на проблемные белки, участвующие в возникновении или распространении заболеваний, лекарство часто закупоривает активный центр белка, поэтому он не может функционировать и сеет хаос. Новые стратегии борьбы с этими белками могут направить эти белки в различные типы механизмов деградации клеточных белков, таких как клеточные лизосомы, которые действуют как белковая дробилка древесины.
В новом исследовании, опубликованном в Наука 20 октября химики из Стэнфорда раскрыли, как работает один из путей, ведущих к этому белку, «измельчителю древесины». Тем самым они открыли двери для новых методов лечения возрастных расстройств, аутоиммунных заболеваний и резистентных к лечению видов рака. Эти результаты могут также улучшить терапию лизосомальных нарушений накопления, которые являются редкими, но часто серьезными заболеваниями, в основном поражающими младенцев и детей.
«Понимание того, как белки доставляются в лизосомы для расщепления, может помочь нам использовать врожденную силу клетки, чтобы избавиться от белков, которые причиняют человеческому организму столько вреда», — сказала Кэролин Бертоцци, исследовательница Энн Т. и Роберта М. Бас-профессор Школы гуманитарных наук и директор семьи Бейкеров Sarafan ChEM-H. «Проделанная здесь работа — это четкий взгляд на обычно непрозрачный внутриклеточный процесс и проливает свет на новый мир возможных открытий лекарств».
«Способность понять биологию этого процесса означает, что мы можем использовать уже существующую биологию и использовать ее для лечения болезней», — сказал Стивен Баник, доцент кафедры химии Школы гуманитарных и естественных наук. «Эти открытия открывают уникальное окно в новый тип биологии, который мы раньше не понимали».
Не дать белкам выйти из строя
Хотя белки часто приносят пользу организму, например, помогают нам переваривать пищу или восстанавливать порванные мышцы, они также могут быть и разрушительными. При раке, например, белки могут стать частью опухоли и/или способствовать ее беспрепятственному росту, вызывать разрушительные заболевания, такие как болезнь Альцгеймера, и накапливаться в сердце, влияя на то, как оно перекачивает кровь в остальные части тела.
Чтобы остановить белки-изгои, можно использовать лекарства, которые блокируют активный центр белка и, таким образом, предотвращают его взаимодействие с клеткой, что было стандартом терапевтических исследований на протяжении десятилетий. Затем, 20 лет назад, на сцену вышли химеры, нацеленные на протеолиз (PROTAC), которые могут задействовать плохо действующие белки, которые уже находятся внутри клетки, и отправлять их на расщепление в лизосомах.
ПРОТАК в настоящее время проходят клинические испытания и доказали свою эффективность при лечении рака. Но они могут воздействовать на белок только в том случае, если он находится внутри клетки, а это только в 60% случаев. В 2020 году исследователи из Стэнфордского университета ChEM-H впервые нашли способ получить остальные 40% этих белков с помощью химер, нацеленных на лизосомы (LYTAC), которые могут идентифицировать и маркировать белки, находящиеся вокруг клетки или на клеточной мембране, для уничтожения. .
Эти открытия положили начало новому классу исследований и терапии, но как именно этот процесс работал, было неясно. Исследователи также заметили, что трудно предсказать, когда LYTAC окажутся очень успешными или не смогут работать так, как ожидалось.
Новые терапевтические цели
В этой работе Грин Ан, доктор философии, тогда аспирант Стэнфорда, а теперь постдокторант в Институте дизайна белков Вашингтонского университета и ведущий автор исследования, использовал генетический экран CRISPR для идентификации и характеристики клеточных структур. компоненты, которые модулируют процесс расщепления белков LYTAC.
Благодаря этому скринингу команда выявила связь между уровнем неддилированного куллина 3 (CUL3) — белка, который играет вспомогательную роль в расщеплении клеточных белков — и эффективностью LYTAC. Точная связь пока не ясна, но чем больше присутствовало неддилатированного CUL3, тем более эффективными были LYTAC.
Измерение уровня неддилатированного CUL3 может стать тестом, позволяющим определить, какие пациенты с большей вероятностью будут реагировать на терапию LYTAC. По словам Бертоцци, это стало неожиданным открытием, поскольку ни одно предыдущее исследование не указывало на эту корреляцию.
Они также определили белки, которые блокируют LYTAC выполнение своей работы. LYTAC работают путем связывания с определенными рецепторами снаружи клетки, которые они используют для доставки плохих белков в лизосомы для деградации. Однако исследователи увидели, что белки, несущие маннозо-6-фосфаты (M6P), сахара, которые украшают белки, предназначенные для лизосом, займут место на этих рецепторах, а это означает, что LYTAC некуда связываться. В результате вмешательства в биосинтез M6P на поверхности клеток появилась увеличенная доля незанятых рецепторов, которые могли быть захвачены LYTAC.
Новая биология, новые пути лечения болезней
Помимо помощи в разработке LYTAC для более эффективных терапевтических средств, эти открытия могут также привести к новым и более эффективным методам лечения нарушений нехватки лизосом — генетических состояний, при которых в организме недостаточно или нужных ферментов в лизосомах для правильной работы. Это может вызвать накопление токсичных жиров, сахаров и других вредных веществ, что может привести к повреждению сердца, мозга, кожи и скелета. Одним из распространенных методов лечения является заместительная ферментная терапия, которая использует те же пути, что и LYTAC, для перемещения к лизосомам, где они могут действовать. Понимание того, как и почему работают LYTAC, означает, что эти ферменты можно будет доставлять более эффективно.
Исследователи сравнили эту работу с важным открытием того, как именно действует препарат талидомид. Первоначально его прописывали в 1950-х годах от утренней тошноты беременным женщинам, в основном в Соединенном Королевстве, но сняли с продажи в 1961 году, когда его связали с тяжелыми врожденными дефектами. Однако в 1990-х годах было обнаружено, что это эффективное лечение множественной миеломы. В 2010 году исследователи поняли, как: через разложение белков, и это наблюдение внесло существенный вклад в растущую область исследований PROTAC.
«Эволюция LYTAC — это то, чем была история талидомида и PROTAC 15 лет назад», — сказал Бертоцци. «Мы изучаем биологию человека, которая раньше не была известна».
Больше информации:
Грин Ан и др., Выяснение клеточных детерминант целевой деградации мембранных белков с помощью химер, нацеленных на лизосомы, Наука (2023). DOI: 10.1126/science.adf6249.
Предоставлено Стэнфордским университетом
Цитирование : Открытие путей расщепления проблемных белков открывает новые возможности лечения (25 октября 2023 г.), получено 25 октября 2023 г. с https://phys.org/news/2023-10-pathways-problem-proteins-treatment-opportunities.html.
Этот документ защищен авторским правом. За исключением любых добросовестных сделок в целях частного изучения или исследования, никакая часть не может быть воспроизведена без письменного разрешения. Содержимое предоставлено исключительно в информационных целях.
 EUROPEAN UNION
EUROPEAN UNION 